藏红花胚性愈伤组织的发生及其调控
藏红花胚性愈伤组织的发生及其调控
陈书安 王晓东 赵兵 王玉春
过程工程学报第7卷第1期 2007年2月
摘要:为提高藏红花胚性愈伤组织的繁殖系数和出芽率,促进其生长和分化,以建立藏红花离体快繁体系,解决藏红花资源短缺问题,研究了藏红花胚性愈伤组织的发生及其调控。结果表明,获得的藏红花球茎1细胞系具有良好的胚性愈伤组织发生能力。胚性愈伤组织生长的优化条件为:在添加3.0mg/L 6-BA,0.25mg/L NAA和400mg/L CH的B5固体培养基上,22℃下全时暗培养25d,繁殖系数达到9g/g。胚性愈伤组织出芽的优化条件为:在添加3.0mg/L 6-BA,0.25mg/L NAA和400mg/L CH的1/2 B5固体培养基上,在22℃及光照强度31.74μmol/(m2⋅s)条件下,每天光照10h,暗培养14h,培养45d出芽率达到44.7%,高于国外报道的20%。
关键词:藏红花;胚性愈伤组织;快繁体系;出芽能力
1前言
藏红花(Crocus sativus L.)是一种名贵的传统妇科良药,其柱头中含有的藏红花素、藏红花苦素等活性成分具有良好的抗癌作用,能够从分子水平上抑制肿瘤的形成,有望成为21世纪最理想的抗癌药物之一,还可用于功能性食品和保健性化妆品的开发。但藏红花资源极其有限,价格昂贵,$2000/kg 左右,被誉为“植物黄金”。通过植物细胞工程建立藏红花快繁体系是解决藏红花资源短缺的有效途径之一。
胚性愈伤组织具有亲本的遗传特性,不论在离体快繁、种质保藏、细胞工程、遗传转化,还是在细胞水平上的生理生化、原生质体、离体诱变等研究方面都具有独特应用,可以作为种质保藏、理化或自发诱变和遗传转化的理想材料,还可制作人工种子或建立无病毒苗的快繁体系,又可用于生理生化及体细胞胚调控的研究,建立良好的原生质体培养体系。
为建立藏红花的快繁体系,国内外诱导了藏红花胚性愈伤组织,并初步优化了培养条件,促使胚性愈伤组织分化成藏红花芽。但其生长和分化条件缺少系统优化,且愈伤生长缓慢,出芽率低,国内报道为1%,国外报道也未超过20%,这限制了藏红花快繁体系的建立。在获得藏红花球茎1细胞系的研究基础上,本研究通过诱导球茎1细胞系获得藏红花胚性愈伤组织,并优化了胚性愈伤组织生长和分化的条件,以提高其增殖系数和分化能力,为建立高效稳定的藏红花再生体系奠定了基础。
2 材料和方法
2.1材料
藏红花愈伤组织球茎1细胞系(黄色,质地疏松,不透明),本实验室诱导和筛选。
2.2 培养基
MS,LS,B5,White和N6培养基。
2.3 胚性愈伤组织的发生及其过程优化方法
将藏红花愈伤组织接种在添加0.25mg/L 2,4-D(2,4-Dichlrophyenoxy acetic acid),2.0mg/L 6-BA(6-Benzyladenine)和200mg/L CH(Casein Hydrolysate,水解酪蛋白)的MS固体培养基上,21℃全时暗培养,观察胚性愈伤组织的发生。
胚性愈伤组织的生长和分化优化均采取单因素法,即将上一个因素的优化结果直接应用到下一个因素的优化实验中。
实验的光照条件若没有特殊指明,均为在31.74μmol/(m2⋅s)的光照强度下,每天光照10h,暗处理14h。
2.4 胚性愈伤组织的干重和鲜重测定方法
从三角瓶中取出藏红花愈伤组织,以滤纸吸净表面水,称重即得鲜重。在60℃烘干至恒重,称重为干重。
2.5 胚性愈伤组织出芽率的统计
将鲜重2.5g的胚性愈伤组织均等分为10份,接种于盛有40mL 1/2 固体培养基的100mL 三角瓶中,在优化条件下培养45d,统计出芽率。
2.6 胚性愈伤组织繁殖系数的计算
3 结果与分析
3.1藏红花胚性愈伤组织的获得
胚性愈伤组织的诱导比一般愈伤组织诱导难度较大,常添加硝酸银,或通过筛选、杂交、转基因等方法获得。从229 株细胞系中筛选出的球茎1细胞系藏红花素1含量高(1.67mg/g)、生长快、不易褐化。通过条件实验,获得了胚性愈伤组织的诱导条件为:将0.6g藏红花愈伤组织接种在添加0.25mg/L 2,4-D,2.0mg/L 6-BA和200mg/L CH的MS固体培养基上,21℃全时暗培养45d后,部分愈伤组织可形成胚性愈伤组织,挑取胚性愈伤组织,颜色为白色,质地坚硬,半透明状。藏红花胚性愈伤组织的照片见图1(a)。
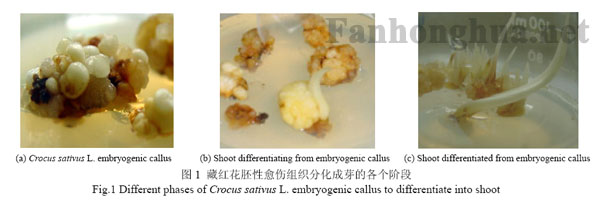
藏红花胚性愈伤组织分化成芽的各个阶段
3.2 激素对藏红花胚性愈伤组织生长和出芽率的影响
较低浓度的生长素和高浓度的细胞分裂素有利于胚性愈伤组织出芽,但浓度过高也会导致其老化死亡。低浓度NAA(Naphthalene Acetic Acid)和高浓度6-BA常用于胚性愈伤组织的生长和分化。将0.6g胚性愈伤组织接种在添加了200mg/L CH和不同种类与浓度的植物激素的MS固体培养基上,全时暗培养25d,测量其生物量和繁殖系数。将鲜重2.5g的胚性愈伤组织均等分为10 份接种于添加了200mg/L CH和不同种类与浓度的植物激素的1/2 MS固体培养基上,21℃光照条件下培养45d,统计出芽率。植物激素对胚性愈伤组织生长和出芽率的影响见表1。
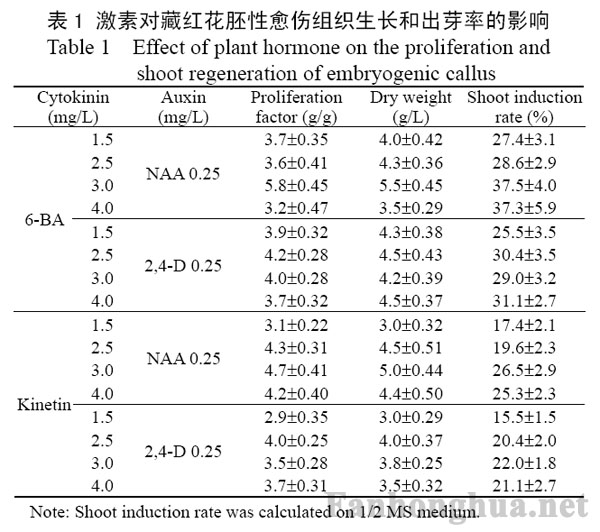
表1 激素对藏红花胚性愈伤组织生长和出芽率的影响
表1表明,3.0mg/L 6-BA和0.25mg/L NAA的组合最有利于藏红花胚性愈伤组织的增殖和出芽,其繁殖系数和出芽率分别达到5.8g/g和37.5%,生物量也达到最高,为5.5g/L(干重),因此以后胚性愈伤组织生长和出芽的条件都是添加3.0mg/L 6-BA和0.25mg/L NAA。胚性愈伤组织分化成芽的照片见图1(b),1(c)。
3.3 基本培养基对胚性愈伤组织生长和出芽率的影响
将0.6g胚性愈伤组织接种在B5,LS,MS,N6和White基本固体培养基上,并均添加200mg/L CH,3.0mg/L 6-BA和0.25mg/L NAA,21℃全时暗培养25d,计算其生物量和繁殖系数。将2.5g胚性愈伤组织接种在不同的1/2上述5种基本固体培养基上,并均添加200mg/L CH,3.0mg/L 6-BA和0.25mg/L NAA,21℃光照条件下培养45d,统计其出芽率。基本培养基对胚性愈伤组织生长和出芽率的影响见表2,表明B5和1/2 B5固体培养基分别最适合胚性愈伤组织的生长和分化,胚性愈伤组织的繁殖系数、生物量(干重)和出芽率分别达到6.6g/g,7.0g/L和38.5%,因此在后续实验中均采用B5和1/2 B5固体培养基分别繁殖和分化藏红花胚性愈伤组织。
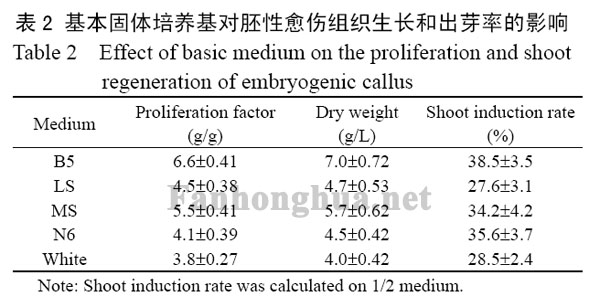
表2 基本固体培养基对胚性愈伤组织生长和出芽率的影响
3.4 温度和光照对藏红花胚性愈伤组织生长和出芽率的影响
将0.6g胚性愈伤组织接种在添加200mg/L CH的B5固体培养基上,并均添加3.0mg/L 6-BA和0.25mg/LNAA,在不同温度,或黑暗或光照条件下培养25d,计算其生物量和繁殖系数。将2.5g胚性愈伤组织接种在添加200mg/L CH的1/2 B5固体培养基上,并均添加3.0mg/L 6-BA和0.25mg/L NAA,在不同温度,或黑暗或光照条件下培养45d,统计其出芽率。不同温度与光照条件对胚性愈伤组织生长和出芽率的影响见表3。
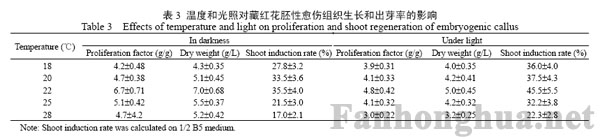
表3 温度和光照对藏红花胚性愈伤组织生长和出芽率的影响
光照与温度是影响胚性愈伤组织生长和分化的重要环境因子,通常暗培养有利于胚性愈伤组织发生、生长和保持,光照对胚性愈伤组织生长不利。本实验中,在相同的温度下,光照处理的胚性愈伤组织与全时暗培养的相比,其生物量和繁殖系数都较低,但出芽率高,这表明光照不利于藏红花胚性愈伤组织的生长和增殖,但有利于其分化出芽,因此在以后的实验中胚性愈伤组织的增殖是在全时暗培养下,而胚性愈伤组织的分化出芽是在光照条件下进行。
培养温度是影响胚性愈伤组织发生和生长的关键因素,还决定了胚性愈伤组织的分化能力,例如当温度超过30℃,一些胚性愈伤组织将会永久失去体细胞胚胎发生能力。在实验的5种温度下,最适合胚性愈伤组织增殖的温度是22℃,在此温度下培养25d,胚性愈伤组织的生物量(干重)达到7g/L,繁殖系数为6.7g/g;最适合胚性愈伤组织分化和出芽的温度也是22℃,在此温度下光照培养45d,出芽率达到45.5%。随着温度的升高,胚性愈伤组织容易褐化,出芽率也随之降低,因此在以后的实验中均在22℃繁殖和分化藏红花胚性愈伤组织。
3.5 CH对藏红花胚性愈伤组织生长和出芽率的影响
将0.6g胚性愈伤组织接种在添加不同浓度CH的B5固体培养基上,并均添加3.0mg/L 6-BA和0.25mg/L NAA,22℃全时暗培养25d,计算其生物量和繁殖系数。将2.5g胚性愈伤组织接种在添加不同浓度CH的1/2 B5固体培养基上,并均添加3.0mg/L 6-BA和0.25mg/L NAA,在22℃光照条件下培养45d,统计出芽率。CH对胚性愈伤组织生长和出芽率的影响见表4。
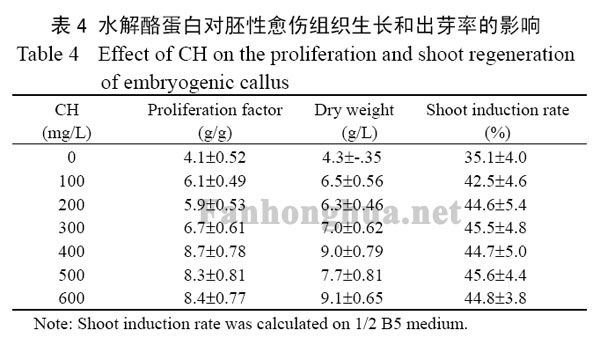
表4 水解酪蛋白对胚性愈伤组织生长和出芽率的影响
水解酪蛋白常作为一种有机添加物促进胚性愈伤组织的发生和生长。表4 表明,水解酪蛋白对胚性愈伤组织的生长、分化和出芽率都有一定的促进作用,当其添加浓度为400mg/L时,胚性愈伤组织的生物量(干重)达到8.7g/L,繁殖系数为9g/g,分别是不添加水解酪蛋白处理组的212%和209%;胚性愈伤组织的出芽率达到44.7%,是对照组(不添加水解酪蛋白)的127%,因此选择400mg/L为CH的初始添加浓度。
4 结论
(1) 以高产藏红花素的球茎1细胞系为材料,诱导并获得了藏红花胚性愈伤组织。
(2) 胚性愈伤组织生长的优化条件为:在添加3.0mg/L 6-BA,0.25mg/L NAA和400mg/L CH的B5固体培养基上,22℃下全时暗培养25d,繁殖系数达到9g/g。
(3) 胚性愈伤组织出芽的优化条件为:在添加3.0mg/L 6-BA,0.25mg/L NAA和400mg/L CH的1/2 B5固体培养基上,在22℃及光照强度31.74μmol/(m2⋅s)下,每天光照10h,暗培养14h,培养45d后出芽率达到44.7%,高于国外报道的20%。
Induction and Regulation of Crocus sativus L. Embryogenic Callus
CHEN Shu-an, WANG Xiao-dong, ZHAO Bing, WANG Yu-chun
Abstract: The induction and regulation of embryogenic callus were investigated to promote the growth and shoot induction rate for micropropagation of Crocus sativus L. The embryogenic callus line was obtained easily from one corm callus line (corm 1). After 25d, the maximum proliferation rate of callus reached 8.9g/g under the optimized condition for cell growth when the callus was cultured on B5 medium supplemented with 400mg/L CH, 0.25mg/L NAA and 3.0mg/L 6-BA at 22℃ in darkness. After 45d, the maximum shoot induction rate of callus reached 45% under the optimized condition for shoot induction when the callus was cultured on 1/2 B5 medium supplemented with 400mg/L CH, 0.25mg/L NAA and 3.0mg/L 6-BA at 22℃ under 16h light with the intensity of 31.74μmol/(m2⋅s) per day, while the highest shoot induction rate of Crocus sativus L. callus was reported only about 20% abroad.
Key words: Crocus sativus L.; embryogenic callus; micropropagation; shoot induction rate
相关内容
标签:藏红花 愈伤组织 组织培养
声明:
1、藏红花网登载此文出于传递更多信息之目的,并不意味着赞同其观点或证实其描述。医学相关、具体治疗及选购请咨询医生或相关专业人士。
2、本站部分图片整理自网络,无法核实真实出处,仅为分享知识,如涉及侵权,请第一时间联系小编删除,谢谢!






